3. L'écriture du bilan de la transformation chimique (20 à 40 min)
Socle commun :
Raisonner, argumenter, pratiquer une démarche expérimentale ou technologique, démontrer (3)
La matière : principales caractéristiques, états et transformations ... (3)
Identifier ses points forts et ses points faibles dans des situations variées (7)
Activité 1 : Lecture ESSENTIELLE (3 min)
Comprendre la chimie :
Comprendre les transformations chimiques c'est comprendre que la matière ne fait que s'organiser autrement.
Les atomes se conservent mais s'attachent autrement (les molécules changent)
Activité 2 : Lire, puis Appliquer pour écrire l'équation de réaction (8 à 10 min)
Le cours :
|
La méthode est toujours la même pour écrire cette équation de réaction : 1. Trouver quels sont les matières que l'on utilise au début et celles que l'on obtient à la fin : quels réactifs ? quels produits ? 2. Ecrire à l'aide de leurs noms : réactifs → produits 3. Ecrire à l'aide de leurs formules : réactifs → produits 4. Equilibrer (ajuster) l'équation de réaction. Comment ? trouver les bons nombres de chaque matière de début et de fin (en s'aidant du fait que les atomes se conservent |
Le piège à éviter : inventer des matières qui ne sont pas là au début ou à la fin
Expliquer oui ! Inventer non !
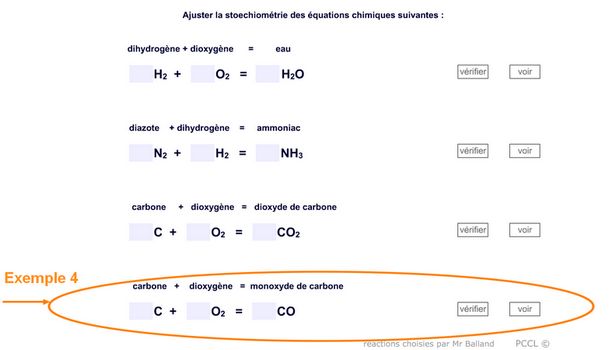
L'exemple pour appliquer : Le charbon (carbone) qui brûle (avec dioxygène)
 Quand le charbon (carbone) brûle (dioxygène) mal, il se forme du monoxyde de carbone : CO. Bruler signifie toujours qu'il y a du dioxygène
Quand le charbon (carbone) brûle (dioxygène) mal, il se forme du monoxyde de carbone : CO. Bruler signifie toujours qu'il y a du dioxygène
- Ecrire en suivant la méthode précédente, l'équation de réaction pour cette transformation chimique
![]()
AU SECOURS, j'ai besoin d'aide ? Cette aide est disponible juste en dessous de cette activité
Conseils :
- nombre de chaque matière : les plus petits possibles
- entourer la formule de chaque matière pour ne pas inventer
- s'aider de dessins pour compter les atomes
Remarque :
- l’équation de réaction n'a aucun intérêt si on ne sait pas expliquer ce qu'elle signifie : signification microscopique
Activité 3 : Collage de la photocopie (2 min)
- Coller la photocopie : comprendre la chimie et écrire une de réaction
![]()
Les équations de réaction sont essentielles pour un chimiste
Activité 4 : Ecrire une autre équation de réaction (7 min)
- Ecrire l'équation de réaction pour la transformation chimique du fer(Fe) qui brûle dans le dioxygène. Il se forme de l'oxyde de fer (Fe3O4)

5 à 7 min
Classe entière
- Lecture par un élève de la photocopie. S'arrêter sur :
1) matière s'organise autrement
2) atomes se conservent
3) piège à éviter
4 expliquer oui ! inventer non !
5) signification microscopique
- Correction rapide par le prof de l'exemple pour appliquer : le charbon qui brûle en s'aidant de l'animation
|
Niveau expert Pour les très à l'aise |
Niveau confirmé Pour ceux qui ont besoin de vérifier qu'ils ont bien compris |
Niveau débutant Pour ceux qui n'ont pas compris |
|
|
Regroupement au fond, avec le prof
|
- Correction de l'activité 4, en partant de la phrase : le fer(Fe) brûle dans le dioxygène. Il se forme de l'oxyde de fer (Fe3O4)
On écrit étape après étape l'équation de réaction
- On insiste sur l'écriture de la signification microscopique de cette équation de réaction (même si légère erreur molécule)
Pour ceux qui ne sont pas encore très à l'aise en équation de réaction, penser à regarder un autre prof explique, ainsi que au secours
![]()
Exo maison :
Proposer l'équation de réaction du dihydrogène qui brule (dioxygène). Il se forme de l'eau
Dans livret